近期,第七屆中國生物醫藥創新合作大會在廣州知識城會展中心盛大開幕。大會聚焦于細胞與基因治療(CGT)產業發展,匯聚權威領袖、行業專家以及投資項目負責人等重磅大咖,以1場全體大會、9場專題論壇的形式展開為期兩日的行業討論。

第七屆中國生物醫藥創新合作大會現場
高騰生物CGT總經理韋慶焜在本次大會上作主題為“細胞基因治療產品的產業化解決方案”的精彩演講,為觀眾展示了高騰生物CGT CDMO的服務范圍與硬核實力。

高騰生物總經理韋慶焜演講
據公開數據顯示,全球CGT大多數處于早期研發階段(包括臨床前研究和臨床Ⅰ期),CGT市場處于萌芽期。我國開展的CGT臨床試驗數量目前位居全球第二,臨床開發熱情高漲。為進一步拓展這個領域,國家從十三五到十四五期間出臺了很多政策與CGT相關的治療原則,旨在加快產業發展。
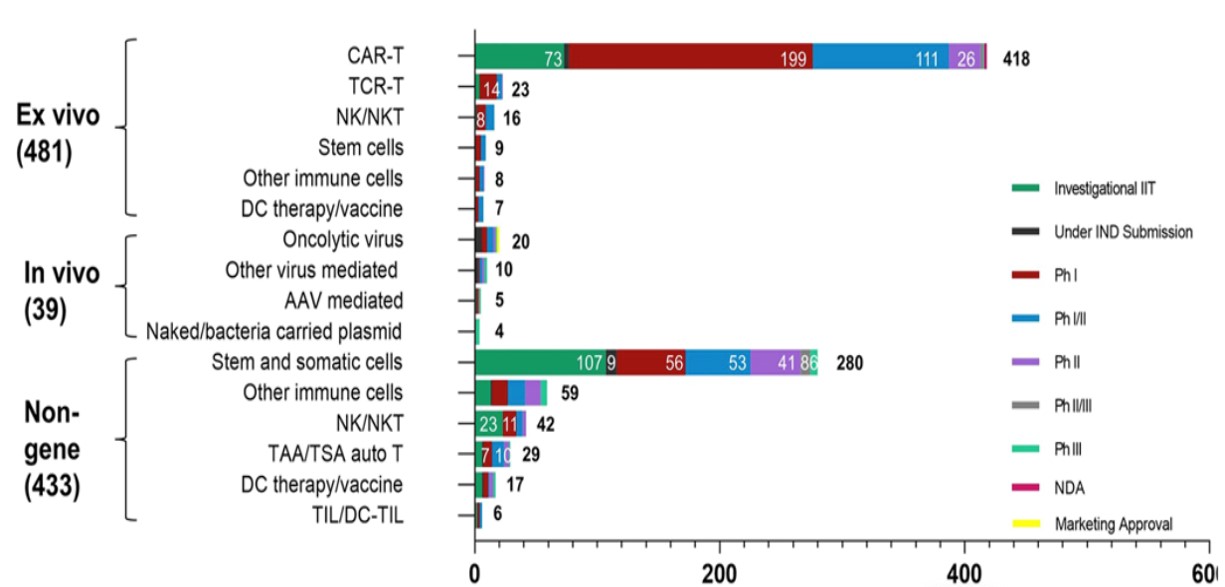
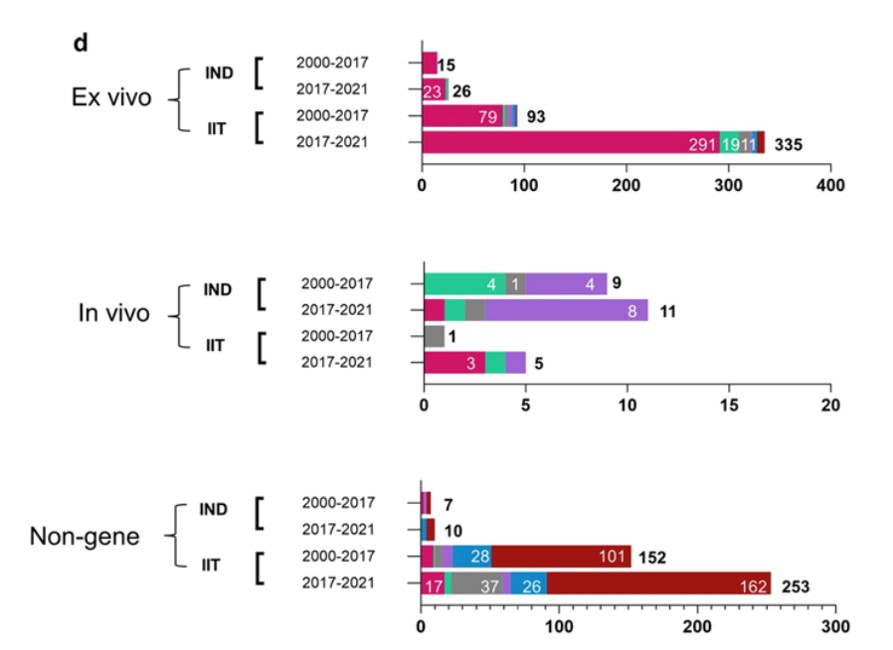
CGT全球研發現狀
Yin et al. Journal of Hematology & Oncology (2022) 15:139
由于復雜的技術機制、高門檻的工藝開發和大規模生產、嚴苛的法規監管要求、有限的產業化經驗,使得CGT產品相比傳統制藥更加依賴CDMO。高騰生物順應產業發展規律,依托漢騰生物已成熟的大分子CDMO服務平臺,致力打造國際化一站式CGT CDMO平臺,專注于提供蛋白、質粒、慢病毒、腺病毒、AAV、免疫細胞、干細胞等生產服務,包括工藝和分析方法開發和驗證、方法學轉移、小試、中試、GMP/商業化生產、IND注冊申報等一站式專業化服務, 竭誠為客戶提供生物類藥物藥理/毒理批、臨床試驗用藥及上市后商業化生產。
談及高騰生物CGT CDMO的服務能力,韋慶焜指出,對于生物制藥產業化的技術平臺,無論抗體藥物還是CGT藥物,底層的產業化邏輯體系都是類似的,一個藥物靶標到一個成熟的商業化產品都需要經過遞送體系、宿主細胞選擇、上游放大方案、下游純化工藝、制劑方法以及貫穿全過程的質量控制等層層挑戰,這也是高騰生物CGT產業化的解決思路。
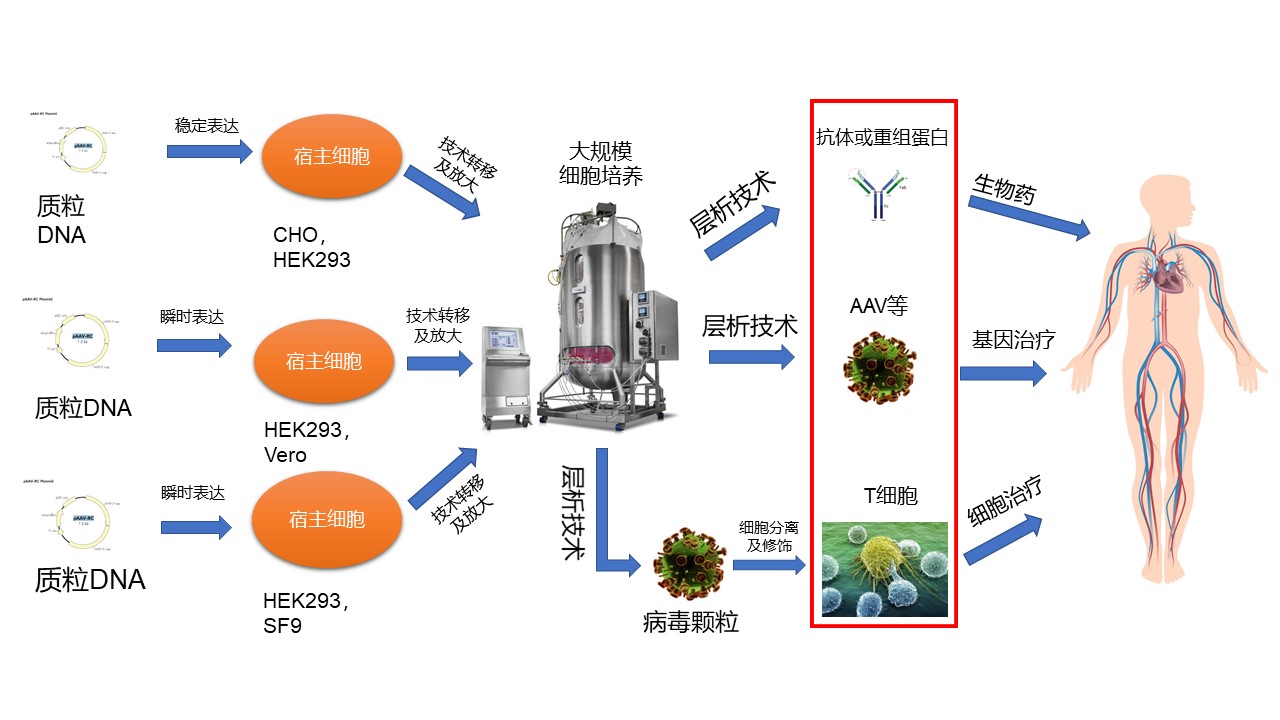
一、藥物遞送體系
病毒載體生產壁壘高、步驟復雜。高騰生物的CGT藥物遞送體系有多個選擇,包括腺病毒(Adv)以及腺相關病毒(AAV)、慢病毒(LV)和溶瘤病毒(HSV)。韋慶焜指出,這些病毒載體各有優勢,比如LV,主要用于T細胞的修飾;AAV適用性更廣泛,理化更穩定,免疫原性低,研究更透徹;HSV對于腫瘤細胞的特異性有更大的優勢。至于選擇哪一種病毒載體,可從藥物性質、給藥方式以及成本等方面考慮。
二、宿主細胞選擇
不同病毒載體導致可選的宿主細胞是有差異的,常用的宿主細胞體系包括了CHO細胞、Vero細胞和GEX細胞等。韋慶焜強調,高騰生物CHO細胞株已獲得商業化授權許可,優勢是高產能力(最高可達20g/L的目標產物表達量),表現出持續良好的生長表型,容易適應各種化學成分限定的培養基,以及能夠進行人類兼容的糖基化等諸多特點,適合大規模工業化培養。
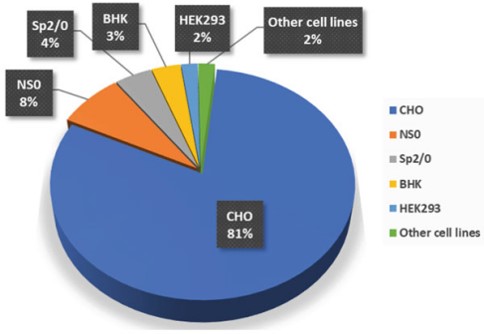
CHO細胞是最常用的宿主細胞,從1987 年到2021年2月,通過培養的哺乳動物細胞生產的獲批生物藥中有 81% 是使用CHO細胞生產。
而Vero細胞因β和α基因缺陷不能表達干擾素蛋白,對病毒易感,適用于各種滅活病毒疫苗的生產,并已擁有商用的HEK293細胞株。另外,GLYCOEXPRESS® (GEX®)細胞是由德國Glycotope公司與漢騰生物聯合開發的源自人類髓性白血病細胞系,其優勢在于灌流培養中表現出優異的生長能力(5*107cell/mg),并且在工藝轉移技術中,我們已完成10L-1000L規模的穩定性測試,幾乎沒有表現差異。
三、上游工藝放大
上游工藝平臺的選擇策略,需要從技術層面(遞送系統、宿主細胞類型等)以及非技術層面(項目階段、目的以及法規、商業價值等)考慮。以病毒載體為例,除固定床反應器/細胞工廠以及攪拌式細胞培養以外,高騰生物的放大工藝亮點在于環軌式懸浮細胞培養技術,最大體積培養可高達2500L,可減少攪拌式培養帶來的剪切力,適應范圍廣。
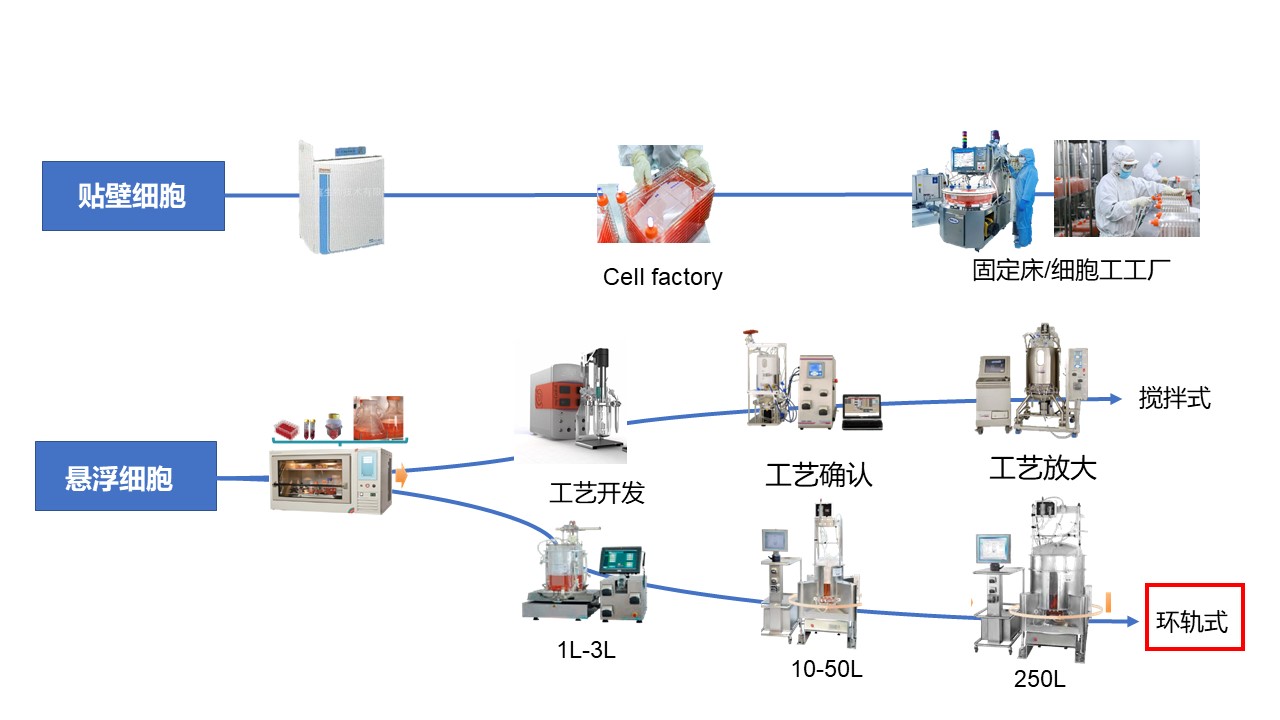
環軌式細胞培養的工藝放大難點中等,運營成本相比較低。
四、下游工藝純化
超速離心雖具備純度高、滴度高和工藝簡單等優勢,但難以實現大規模生產。韋慶焜提出,商業化生產需要標準化、規模化和流程化,高騰生物的下游工藝純化平臺主要通過澄清、超濾和純化等步驟來實現,還可以把控無菌、工藝穩定性等指標。
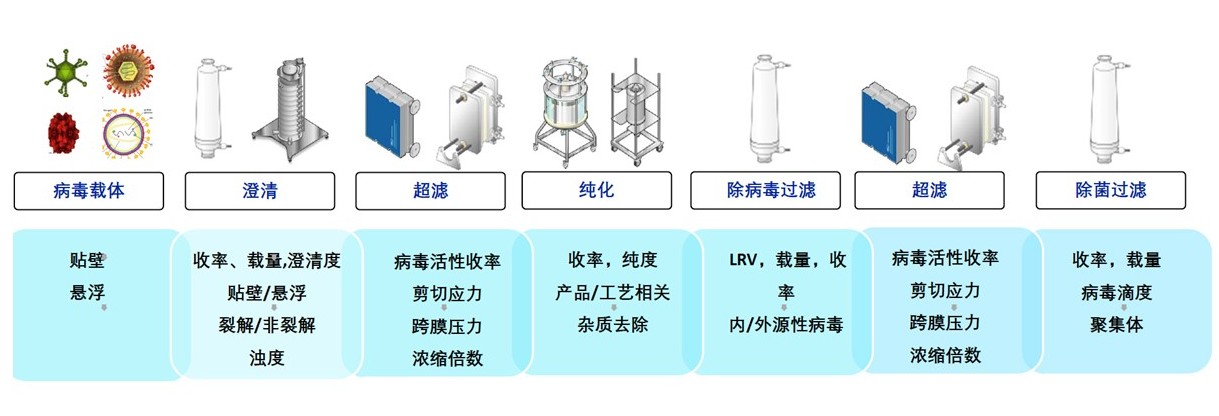
標準的病毒載體下游工藝平臺建立
五、制劑方案開發
考慮給藥方式,那就要建立制劑處方和工藝開發平臺。通常在選定制劑方案和包材之后,還需要考慮可開發性研究,處方和工藝開發,對制劑的穩定性進行考察。除液體、凍干等制劑形式外,鼻噴制劑成為基因治療/蛋白產品的一種新給藥方式,高騰生物具備完整的鼻噴制劑方案開發能力。

高騰生物可進行液體、凍干、鼻噴/吸入式制劑方案開發
六、質量體系控制
質量控制是CGT研發過程中最復雜的事。高騰生物已建立研發階段和符合GMP生產階段的質量管理體系和管理流程,持續維持法規要求,符合CGT項目申報或商業化上市審查。研發及生產過程中,我們不僅需要對質粒、病毒載體和細胞等方面進行質控,還需要保證實驗數據的完整性、真實性和可追溯性。
面對層層挑戰,高騰生物專注技術創新,攻堅生產“卡脖子”問題。韋慶焜表示,在國家政策支持以及投融資環境良好的背景下,高騰生物以成為粵港澳大灣區CGT CDMO龍頭企業,業務輻射至亞洲、歐洲等海外市場為目標,致力于為國內外CGT公司提供從研發到商業化生產的一站式CDMO服務。
關于高騰生物:
高騰生物是一家專注于打造領先CGT CDMO 服務平臺的企業,由廣州漢騰生物科技有限公司與廣州高新區投資集團有限公司協同合作開發,核心團隊由具有專業科研和管理經驗的優秀人才組成,業務覆蓋蛋白、質粒、科研級/工業級病毒、免疫細胞、干細胞生產工藝和分析方法學開發及驗證、中試生產、分析和質量控制、方法學轉移、IND申報等。
目前有深圳光明區研發和工藝開發中心和廣州黃埔區中試和生產中心兩大基地。基地建設基于QbD理念設計,具備符合國際標準的cGMP生產設施,獨立的GMP生產線,全封閉系統,有效防止批間交叉污染;另外,產能布局靈活,滿足不同IND到BLA到商業化規模的生產。